MODELLO DI BOHR DELL'ATOMO DI IDROGENO
Gli studi sulle interazioni delle onde elettromagnetiche con la materia iniziarono verso la meta' del 1800. In quel periodo era gia' stato raggiunto un buon grado di conoscenza della struttuta atomica ed erano ben noti molti spettri di emissione di luce relativi ad atomi stimolati dal calore o da una scarica elettrica. Gli spettri di emissione consistevano in linee discrete, ben distinte e situate in corrispondenza di differenti frequenze. Furono fatti numerosi tentativi per spiegare teoricamente le osservazioni sperimentali ma, non avendo a disposizione un modello atomico ancora accettabile, risultava impossibile fornire una interpretazione teorica dei dati.
Osservazioni effettuate:
Emissione di luce da parte di un campione di idrogeno a bassa pressione quando questo era attraversato da corrente elettrica. In pratica, la corrente, costituita da uno sciame di elettroni, demoliva le molecole di idrogeno H2 ed eccitava, ad energia superiore, gli atomi di idrogeno H resi indipendenti. Gli atomi eccitati emettevano radiazione elettromagnetica per liberarsi dell'energia eccedente e poi si ricombinavano formando nuovamente molecole H2.
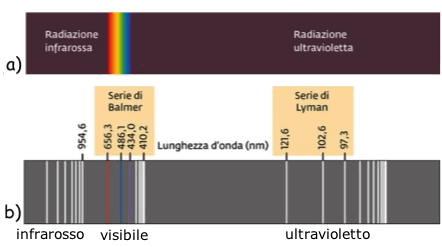
Osservazione di uno spettro luminoso continuo (figura a) quando un prisma veniva attraversato da un raggio di luce bianca.
Osservazione di uno spettro a righe (figura b) quando un prisma veniva attraversato dalla luce emessa da atomi di idrogeno eccitati. La riga spettrale piu' brillante era la riga rossa (656 nm) e gli atomi eccitati del gas brillavano proprio di luce rossa. Essi emettevano anche radiazioni ultraviolette ed infrarosse invisibili all'occhio umano, ma rivelabili elettronicamente e fotograficamente.
Lo spettro completo di emissione dell'idrogeno atomico e' riportato in figura, insieme ai diversi gruppi di righe spettrali, detti serie (due serie di righe spettrali sono riportate con i rispettivi nomi):
Un modello dell'atomo di idrogeno che metteva insieme il modello nucleare di Rutherford (1911) con i risultati di Planck e di Einstein fu proposto da Bohr nel 1913.
Il modello di Bohr ebbe un grande successo nel calcolo delle lunghezze d'onda dello spettro noto dell'idrogeno. Bohr ipotizzo' che l'elettrone dell'atomo di idrogeno si muovesse attorno al nucleo sotto l'influenza della forza di attrazione coulombiana e che descrivesse orbite ellittiche. La forza di attrazione era diretta verso il nucleo positivo dell'atomo ed il centro della forza era localizzato in un fuoco, proprio come avveniva nel moto dei pianeti attorno al Sole.
Per descrivere in maniera semplice il moto dell'elettrone attorno al nucleo, Bohr scelse un'orbita circolare, anziche' ellittica, come indicato in figura:
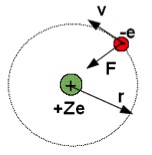 L'elettrone
di carica -e percorre un'orbita circolare di raggio r attorno alla
carica nucleare +Ze. La forza attrattiva elettrica F = kZe2/r2
fornisce
la forza centripeta che mantiene l'elettrone nella sua orbita: F =
kZe2/r2
=
mv2/r.
L'elettrone
di carica -e percorre un'orbita circolare di raggio r attorno alla
carica nucleare +Ze. La forza attrattiva elettrica F = kZe2/r2
fornisce
la forza centripeta che mantiene l'elettrone nella sua orbita: F =
kZe2/r2
=
mv2/r.
Era comunque noto che un modello di questo tipo conducesse, secondo la teoria classica, ad un atomo elettricamente instabile, pur garantendo una stabilita' meccanica. Infatti, la forza attrattiva di Coulomb rappresentava la forza centripeta necessaria a far rimanere in orbita l'elettrone, il quale pero', dovendo accelerare, irraggiava, durante il suo moto circolare, energia elettromagnetica con una frequenza uguale a quella del suo moto. Dunque, secondo la teoria elettromagnetica classica, l'elettrone sarebbe dovuto cadere sul nucleo dell'atomo con un moto a spirale, emettendo la propria energia ed inducendo l'atomo a collassare rapidamente. Bohr riusci' a risolvere questa difficolta' formulando i seguenti postulati:
Postulato 1
L'elettrone, nell'atomo di idrogeno, puo' muoversi solo su certe orbite circolari non–radiative. Bohr chiamo' “stati stazionari” queste orbite stabili.
Postulato 2
L'atomo emette un fotone quando l'elettrone compie una transizione da uno stato stazionario ad un altro. La frequenza del fotone e' data dalla relazione: ʋ = (Ei- Ef)/h, dove Ei ed Ef sono rispettivamente l'energia iniziale dell'orbita e quella finale ed h e' la costante di Planck.
Postulato 3
Il raggio di un'orbita stazionaria e' determinato dalla fisica classica, con l'aggiunta della condizione quantistica che il momento angolare dell'elettrone deve uguagliare il rapporto tra un multiplo della costante di Planck e 2π, ossia: mvr = nh/2π. Quindi, il momento angolare e' quantizzato.
L'analisi del moto dell'elettrone nell'atomo di idrogeno, secondo cui la forza centrifuga era bilanciata dall'attrazione coulombiana tra elettrone e nucleo, con in piu' l'ipotesi della quantizzazione del momento angolare, porto' a risultati in perfetto accordo con i dati sperimentali.
I postulati di Bohr permisero di dedurre i livelli energetici consentiti nell'atomo di idrogeno, esprimibili mediante la relazione:
En = - Z2∙E0 /n2
dove E0 = 13,6 eV ed n e' il “numero quantico principale”.
Spiegazione dello spettro
I livelli energetici nell'atomo di idrogeno erano dunque livelli ben definiti e risultavano chiari anche i salti di energia. Considerando la formula di Planck, secondo cui l'energia dei fotoni risultava essere proporzionale alla frequenza, era evidente che i fotoni emessi dovessero avere poche e ben definite frequenze, proprio quelle osservate negli spettri:
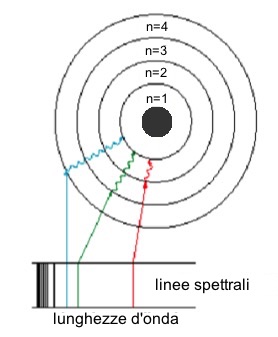 Le
“righe spettrali” osservate sperimentalmente erano provocate
dalle transizioni tra i livelli energetici atomici
consentiti.
Le
“righe spettrali” osservate sperimentalmente erano provocate
dalle transizioni tra i livelli energetici atomici
consentiti.
La relazione hʋ = Esup- Einf e' nota come legge di Bohr.
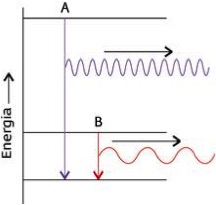 Durante
una transizione dell'elettrone da uno stato di energia superiore Esup
ad
uno di energia piu' bassa Einf
l'atomo perde energia sotto forma di un fotone.
Quanto maggiore e' la perdita di energia, tanto piu' elevata e' la
frequenza (e minore e' la lunghezza d'onda) della radiazione emessa.
Durante
una transizione dell'elettrone da uno stato di energia superiore Esup
ad
uno di energia piu' bassa Einf
l'atomo perde energia sotto forma di un fotone.
Quanto maggiore e' la perdita di energia, tanto piu' elevata e' la
frequenza (e minore e' la lunghezza d'onda) della radiazione emessa.
CONCLUSIONI
Bohr collego' la nozione di quanto di energia con il movimento rotatorio degli elettroni intorno al nucleo.
In base alla sua teoria gli elettroni in un atomo possono trovarsi solo in particolari livelli energetici detti “stati quantici”, i quali spiegano la stabilita' dell'atomo. Quando gli elettroni si trovano in uno stato quantico, l'atomo non emette energia. Viene emesso un "quanto" di energia solo quando un elettrone passa da uno stato di energia maggiore ad uno minore, la differenza tra queste due energie e' pari proprio al quanto emesso: ΔE = hʋ.
Quando l'atomo viene colpito da radiazione di una certa frequenza, l'assorbimento di un quanto di energia permette il passaggio di un elettrone da un livello energetico inferiore ad uno superiore.
In definitiva, Bohr riusci' a dimostrare teoricamente la stabilita' degli atomi che il modello di Rutherford non era stato in grado di fornire.