L'ENTROPIA DI CLAUSIUS
Legge di aumento di entropia

Julius Emanuel Clausius (1822-1888)
La parola “entropia” venne introdotta, per la prima volta, dal fisico e matematico tedesco Rudolf Clausius nel suo trattato sulla teoria meccanica del calore: “Abhandlungen uber die mechanische Warmetheorie”, pubblicato nel 1864.
Clausius defini' l'entropia in termini di calore e temperatura, arrivando all'importante risultato secondo cui in un sistema isolato, nel quale avvengono processi spontanei, l'entropia non puo' diminuire, ma essa aumenta sempre.
DEFINIZIONE DI CLAUSIUS DI ENTROPIA
L'entropia S di un sistema e' una funzione di stato1 la cui variazione, nel passaggio del sistema da uno stato A ad un altro stato B, puo' essere calcolata considerando una trasformazione ideale reversibile2 tra i due stati. L'espressione matematica della variazione di entropia e' data dalla sommatoria su tutti gli scambi di calore, alla temperatura a cui avviene ciascuno scambio, che fanno passare il sistema da uno stato iniziale A ad uno stato finale B con una trasformazione reversibile, cioe':
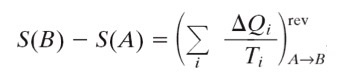
L'unita' di misura dell'entropia S, nel Sistema Internazionale, e' J/K (Joule/Kelvin).
E' dimostrabile che:
In un sistema isolato dove hanno luogo solo trasformazioni reversibili l'entropia rimane costante, (ossia la variazione totale di entropia e' nulla ΔS=0).
In un sistema isolato dove hanno luogo trasformazioni irreversibili3 l'entropia aumenta (ΔS>0).
Quindi:
Ogni trasformazione che avviene in un sistema isolato provoca una variazione di entropia ΔS > 0 (= 0 se e solo se la trasformazione e' reversibile).
Guarda il filmato: L'entropia nei sistemi isolati e non AMALDI ZANICHELLI
Clausius intui' che i due enunciati del Secondo Principio della Termodinamica, (enunciato di Clausius ed enunciato di Kelvin - tra loro equivalenti) non erano altro che una conseguenza di un'unica legge generale, esprimibile in termini della funzione di stato entropia. Questa legge e' il “principio di entropia” o “legge di aumento di entropia”, secondo cui:
l'evoluzione spontanea di un sistema isolato porta il sistema ad uno stato di equilibrio a cui corrisponde il massimo aumento dell'entropia (compatibilmente con il primo principio della termodinamica).
1Funzione di stato: grandezza il cui valore dipende soltanto dalle condizioni di equilibrio in cui si trova il sistema e non da come tali condizioni sono state raggiunte. Esempi di funzioni di stato sono: la pressione, la temperatura, il volume, l'energia interna.
2Trasformazioni reversibili: una trasformazione si dice reversibile se avviene attraverso una successione di stati di equilibrio ed in assenza di effetti dissipativi (ad esempio l'attrito). Se una trasformazione avviene in maniera reversibile, lo stato iniziale del sistema puo' essere ripristinato senza effetti osservabili sul sistema e sull'ambiente. Le trasformazioni reversibili sono trasformazioni ideali, poiche' in natura e' impossibile una totale assenza di effetti dissipativi.
3Trasformazioni irreversibili: sono le trasformazioni che normalmente avvengono nella realta'; ad esempio, una esplosione e' un fenomeno chimico-fisico evidentemente non reversibile. Queste trasformazioni avvengono in un tempo finito e presentano effetti dissipativi. Esse sono caratterizzate non tanto dal fatto che il sistema non possa essere ricondotto allo stato iniziale, ma dal fatto che cio' non puo' avvenire senza che nell'ambiente circostante ne rimanga traccia. Un tipico esempio di trasformazione irreversibile e' l'espansione libera di un gas. Durante un'espansione libera (cioe' non contrastata da nessuna forza esterna), il gas non compie lavoro sull'ambiente, mentre per riportare il gas al suo stato iniziale, bisogna compiere lavoro sul gas, il quale non potrebbe tornare ad occupare spontaneamente il volume di partenza. In una trasformazione irreversibile la "traccia" che rimane nell'ambiente e' l'energia che e' necessario spendere per riportare il sistema al suo stato iniziale.