

IL CARBONIO
![]() Il
carbonio e'
il piu' versatile tra gli elementi chimici; i “composti
organici” formati
dal carbonio superano in numero tutti gli altri composti chimici.
Il
carbonio e'
il piu' versatile tra gli elementi chimici; i “composti
organici” formati
dal carbonio superano in numero tutti gli altri composti chimici.
Il numero atomico del carbonio e' Z = 6; esso rappresenta il numero di protoni presenti in un nucleo atomico ed e' uguale al numero di elettroni in un atomo neutro. La configurazione elettronica del carbonio e':
1s22s22p2
La rappresentazione grafica della configurazione elettronica del carbonio, ossia la distribuzione degli elettroni all'interno dei diversi livelli energetici degli orbitali atomici, e' la seguente:

Gli orbitali atomici sono rappresentati nella figura con dei quadratini, mentre gli elettroni sono rappresentati con delle frecce all'interno dei quadratini; il verso delle frecce indica lo stato di spin dell'elettrone.
La configurazione elettronica degli atomi, con particolare riferimento a quella dell'atomo di carbonio, puo' essere spiegata sinteticamente analizzando:
Tabella 1 - qui sono riportati i valori dei numeri quantici degli elettroni atomici ed il numero di elettroni che ciascun sottolivello e livello energetico di un atomo puo' contenere:
 Tabella
1
Tabella
1
Tabella 2 - essa racchiude sinteticamente i numeri quantici degli elettroni atomici e ne specifica il significato:
 Tabella
2
Tabella
2
orbitali
atomici di tipo “s” e di tipo “p”, le cui
forme sono:
Il primo livello energetico (n = 1), coincidente anche con il sottolivello, ha un solo orbitale atomico di forma sferica (1s) e contiene un massimo di 2 elettroni con spin antiparallelo.
Il secondo livello energetico (n = 2) e' suddiviso in due sottolivelli:
il sottolivello 2s - esso e' il piu' povero di energia ed ha un solo orbitale atomico di forma sferica; il suo raggio e' maggiore rispetto a quello dell'orbitale atomico 1s. Il sottolivello 2s puo' contenere un massimo di 2 elettroni con spin opposto;
il sottolivello 2p - esso ha tre orbitali atomici ed ognuno di loro rassomiglia ad una doppia pera contrapposta (2 lobi); l'asse, lungo il quale ciascun orbitale atomico si allunga maggiormente, coincide con uno degli assi cartesiani dello spazio (x,y,z). Il secondo sottolivello puo' contenere un massimo di 6 elettroni (2 per orbitale). L'atomo di carbonio contiene solo 2 elettroni in questo sottolivello energetico.
Il secondo livello energetico dunque contiene un massimo di 8 elettroni. L'atomo di carbonio contiene solo 4 elettroni in questo livello energetico.
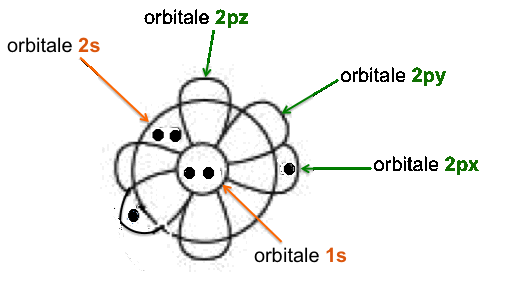 Rappresentazione
semplificata
delle forme
e del
riempimento
di
tutti gli
orbitali dell'atomo
di carbonio.
Rappresentazione
semplificata
delle forme
e del
riempimento
di
tutti gli
orbitali dell'atomo
di carbonio.
La distribuzione degli elettroni in un atomo segue il Principio di esclusione di Pauli che si puo' enunciare in due modi diversi:
all'interno di un orbitale atomico possono essere presenti contemporaneamente al massimo due elettroni, purche' abbiano spin opposti, ossia spin antiparalleli.
in uno stesso atomo non vi possono essere due elettroni con tutti e quattro i numeri quantici uguali (n, l, ml ms). Questo significa che se, per esempio, sono uguali i primi tre numeri quantici (n, l, ml), due elettroni si trovano nello stesso orbitale atomico e quindi il quarto numero quantico (ms) deve essere diverso. Poiche' i valori del numero quantico di spin sono: ms = +1/2 oppure ms = -1/2 e' chiaro che i due elettroni devono avere spin opposti.
IL CARBONIO IN NATURA
In natura il carbonio e' presente in forme cristalline diverse dette allotropiche, dal greco αλλοσ (altro) e τροποσ (modo). Le forme allotropiche del carbonio sono:
Nelle forme allotropiche gli atomi di carbonio sono chimicamente legati tra loro in maniera differente, per questo motivo esse posseggono diverse proprieta' fisico-chimiche.
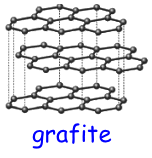
La
grafite
e'
la struttura piu' comune tra le forme allotropiche del carbonio
 e la si puo' trovare nella
mina di una semplice matita
e la si puo' trovare nella
mina di una semplice matita
![]() .
La grafite si compone di strati planari di atomi di carbonio,
formanti un reticolo a maglie esagonali, in cui ogni atomo di
carbonio e' legato ad altri 3 atomi.
.
La grafite si compone di strati planari di atomi di carbonio,
formanti un reticolo a maglie esagonali, in cui ogni atomo di
carbonio e' legato ad altri 3 atomi.
Sotto
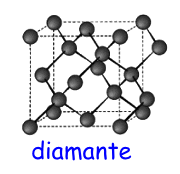
alte pressioni, la grafite puo' trasformarsi in diamante
 ;
in
questo caso, gli atomi di carbonio sono legati l'uno all'altro
mediante legami covalenti
che formano
una struttura tetraedrica e
rendono il diamante molto resistente alla deformazione.
;
in
questo caso, gli atomi di carbonio sono legati l'uno all'altro
mediante legami covalenti
che formano
una struttura tetraedrica e
rendono il diamante molto resistente alla deformazione.
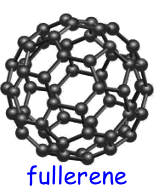
Il fullerene possiede invece una struttura sferica. Il piu' comune e' il C60, costituito da 60 atomi di carbonio che formano 20 esagoni e 12 pentagoni, disposti in modo tale da assumere la forma di una sfera cava.
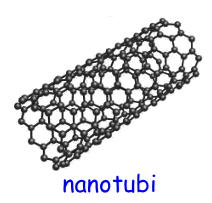
I nanotubi di carbonio hanno forma cilindrica e possono essere distinti in due categorie:
SWCNT (Single-Walled Carbon NanoTube), nanotubo a parete singola, costituito da un singolo foglio di grafite avvolto su sé stesso.
MWCNT (Multi-Walled Carbon NanoTube), nanotubo a parete multipla, formato da piu' fogli di grafite avvolti coassialmente uno sull'altro.