DUALISMO ONDA – PARTICELLA
NATURA ONDULATORIA DELLA MATERIA
Gli elettroni, ritenuti normalmente delle particelle, presentano anche proprieta' ondulatorie tipiche dei fenomeni di interferenza e di diffrazione della luce.
Fu Louis de Broglie nel 1924 a sostenere che ogni corpo microscopico, come ad esempio un fotone oppure un elettrone, dovesse avere una doppia natura, cioe' quella di “onda” e quella di “particella”. Egli ipotizzo' che tra la quantita' di moto p = mv di una particella e la lunghezza λ di un'onda esistesse la relazione:
λ = h/mv
con h costante di Planck
L'espressione λ = h/p e' nota con il nome di relazione di de Broglie.
Questa relazione e' valida anche per i fotoni; difatti, considerando che la quantita' di moto di un fotone e' legata alla sua energia dalla relazione p = E/c, si puo' scrivere:
λ = c/ʋ = hc/hʋ = hc/E = h/(E/c) = h/p
La natura ondulatoria degli elettroni fu confermata sperimentalmente dal fenomeno di diffrazione che si osservo' inviando un fascio di elettroni veloci contro un cristallo isolato di nichel. L'esperimento fu effettuato per la prima volta nel 1925 dagli scienziati americani Clinton Davisson e Lester Germer. L'immagine di diffrazione, prodotta dagli elettroni, era da attribuire alla disposizione regolare degli atomi nel reticolo cristallino.
Nel 1927, George Paget Thomson, operando ad Aberdeen in Scozia, dimostro' che un fascio di elettroni produceva un'immagine di diffrazione anche attraversando una lamina sottile d'oro, come mostrato in figura:
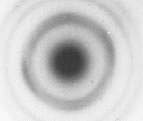
Invece, la prova che l'elettrone sia anche una particella e' data dalla scia, simile a quella tracciata da un aereo, che questa particella produce attraversando una camera a nebbia, come indicato in figura:
 Scie
lasciate dagli elettroni in una camera a nebbia.
Scie
lasciate dagli elettroni in una camera a nebbia.
Dunque, gli elettroni presentano una doppia natura, essi non sono solo semplici particelle classiche, ma possono avere anche comportamenti ondulatori rilevabili.
La lunghezza d'onda associata ad un elettrone e' inversamente proporzionale alla sua quantita' di moto.
STABILITA' DEGLI ATOMI E LUNGHEZZA D'ONDA DI LOUIS dE BROGLIE
La relazione di de Broglie (λ = h/p) ebbe una immediata applicazione nell'interpretazione della stabilita' delle orbite elettroniche degli atomi. Difatti, se l'elettrone possedeva proprieta' ondulatorie, il suo movimento non doveva essere interpretato come il moto di un corpuscolo attorno ad un nucleo centrale dal quale l'elettrone veniva attratto, ma doveva corrispondere alla vibrazione di un'onda stazionaria chiusa su se stessa:
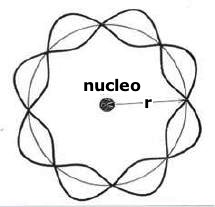 Rappresentazione
ondulatoria dell'elettrone attorno al nucleo nell'atomo di idrogeno:
onde stazionarie su una circonferenza.
Rappresentazione
ondulatoria dell'elettrone attorno al nucleo nell'atomo di idrogeno:
onde stazionarie su una circonferenza.
Inoltre, la relazione di Louis de Broglie implicava un'equivalenza tra l'espressione fornita da Bohr per la quantizzazione del momento angolare (mvr = pr = nh/2π) e la condizione riguardante la formazione di onde stazionarie sull'orbita elettronica. Difatti, dalle seguenti relazioni:
pr = nh/2π
e
λ = h/p
si deduce che:
2πr = nλ = C
dove C e' la circonferenza dell'orbita di Bohr.
Dunque, la condizione quantistica di Bohr ed il fatto che la circonferenza dell'orbita elettronica dovesse contenere esattamente un numero intero “n” di lunghezze d'onda λ di de Broglie erano da ritenere condizioni tra loro equivalenti. Pertanto, la prima orbita (n=1) doveva contenere una sola lunghezza d'onda; la seconda orbita (n=2) doveva contenere due lunghezze d'onda e cosi' via, e cio' conduceva alla formazione di onde stazionarie.
Un'onda di questo tipo (stazionaria), dopo aver compiuto un'orbita completa, viene a trovarsi esattamente in fase con se stessa; ad essa non sono consentite altre orbite poiche', in qualsiasi altro caso, si verrebbe a creare interferenza distruttiva e l'onda si estinguerebbe:
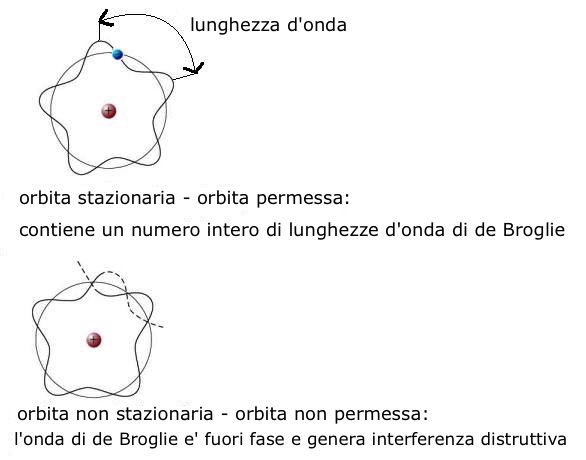 Orbita
dell'elettrone.
Orbita
dell'elettrone.
E' interessante osservare che una analoga situazione si verifica prendendo in considerazione una chitarra con una sua corda di lunghezza L fissata al ponte ed al capotasto. Gli estremi della corda, essendo fissi, ne condizionano la sua vibrazione. In pratica, usando la chitarra, quando si sollecita una corda, l'onda cosi' prodotta si riflette ai suoi estremi ed interferisce con se stessa, formando proprio un'onda stazionaria. In un sistema di questo tipo sono possibili solo alcuni modi discreti di vibrazione, ossia:
la lunghezza d'onda deve essere un sottomultiplo intero del doppio della lunghezza della corda.
In altre parole, la corda puo' contenere solo un numero intero di mezze lunghezze d'onda e puo' produrre solo quelle vibrazioni per le quali sia soddisfatta la relazione:
n∙λ/2 = L
con n = 1, 2, 3, 4........ e con L lunghezza della corda.
La precedente espressione puo' anche essere scritta come:
λ = 2L/n
con n = 1,2,3,4......
Questa relazione rappresenta, nella teoria classica ondulatoria, la condizione per generare onde stazionarie. Le vibrazioni che non rispettano questa condizione sono impossibili.
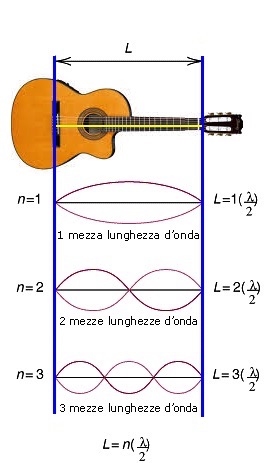 Possibili
vibrazioni di una corda di lunghezza L in una chitarra; sono
consentite solo onde stazionarie.
Possibili
vibrazioni di una corda di lunghezza L in una chitarra; sono
consentite solo onde stazionarie.
Le onde stazionarie implicano energie quantizzate
Infatti:
per le onde stazionarie la frequenza e' quantizzata: ʋ = v/λ = nv/2L, con v velocita' di propagazione dell'onda. Associando poi l'energia alla frequenza, cioe' considerando che ʋ = E/h, appare evidente che le onde stazionarie comportino energie quantizzate.
LUNGHEZZA D'ONDA DI LOUIS dE BROGLIE E LIVELLI ENERGETICI
Una straordinaria conseguenza della concezione ondulatoria di de Broglie consiste nella possibilita' di dedurre da essa l'esistenza di livelli energetici discreti per particelle confinate entro spazi limitati. Cio' permette di affermare che l'origine delle regole di quantizzazione sia da attribuire proprio alla natura ondulatoria dell'elettrone o, in generale, di una particella.
A tal proposito, si supponga che una particella di massa m sia contenuta in una buca di larghezza L, a pareti infinitamente alte, e che la particella si muova con velocita' v in direzione orizzontale. L'energia cinetica della particella E = ½ mv2 risulta infinitamente piu' piccola dell'energia potenziale gravitazionale (calcolata rispetto al fondo della buca) che la particella avrebbe nei punti esterni della buca; la particella, non potendo mai uscire dalla buca, ne resta intrappolata.
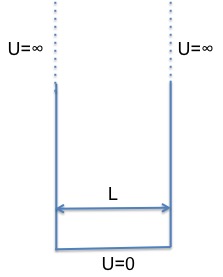 Rappresentazione
schematica dell’energia potenziale U di una particella posta in una
buca a pareti infinitamente alte. Se si assume come livello di
riferimento il fondo della buca, si ha U=0 sul fondo della buca,
mentre ai bordi U=∞.
Rappresentazione
schematica dell’energia potenziale U di una particella posta in una
buca a pareti infinitamente alte. Se si assume come livello di
riferimento il fondo della buca, si ha U=0 sul fondo della buca,
mentre ai bordi U=∞.
Secondo la concezione ondulatoria di de Broglie, una particella vincolata in una scatola monodimensionale, avendo carattere ondulatorio, puo' essere vista proprio come un'onda stazionaria su una corda:
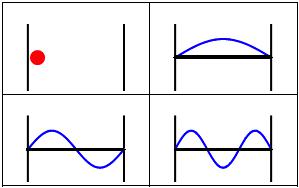
Dunque, l'elettrone, essendo intrappolato nell'atomo, per effetto dell'attrazione del nucleo, e' da paragonare proprio alla particella intrappolata nella scatola con pareti poste alla distanza L. Percio', anche l'elettrone, come la particella, potra' essere descritto da un'onda stazionaria di lunghezza d'onda espressa dalla relazione:
λ = 2L/n
con n=1,2,3,4......
In definitiva, proprio come accade per la lunghezza della corda di chitarra, le sole onde che si possono formare sono quelle la cui semi-lunghezza d'onda λ/2 si ripete, nella distanza L, un numero intero di volte.
Applicando la relazione di de Broglie, possono essere ottenuti i valori di quantita' di moto consentiti:
p = h/λ
λ = 2L/n
p = n∙(h/2L)
Considerando che l'energia cinetica della particella e' esprimibile anche in funzione della sua quantita' di moto, ossia:
E = p2/2m
sostituendo l'espressione di p in quella dell'energia cinetica, e' possibile ricavare i valori di energia consentiti alla particella:
E = n2∙(h2/8mL2)
Da questa relazione, che si discosta notevolmente dai risultati della Fisica classica, si deduce che l'energia della particella non puo' essere qualsiasi ma risulta quantizzata, dovendo essere un multiplo della quantita' h2/8mL2, secondo i valori 1, 4, 9 ecc.
Quindi, anche se la particella nella scatola non corrisponde ad un modello realistico, da questo esempio si puo' comprendere come l'esistenza dei livelli energetici nasca proprio dalla natura ondulatoria delle particelle materiali.
In figura sono riportate le prime sei funzioni d'onda e le rispettive energie per il sistema noto come “particella nella scatola”. Le cifre che, in figura, compaiono a sinistra rappresentano i valori del numero intero “n”, noto con il nome di “numero quantico”:
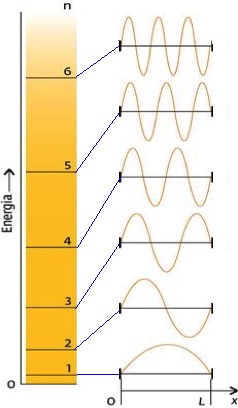
Uno svilippo ulteriore di queste teorie si ebbe tra il 1926 ed il 1930, grazie al fisico austriaco Erwin Schrödinger che, con la sua equazione riguardante le “onde elettroniche”, risolse il problema delle onde stazionarie per l'atomo di idrogeno.
CONCLUSIONI
La luce, che di solito immaginiamo come un'onda, mostra proprieta' corpuscolari quando interagisce con la materia, come dimostrato dall'effetto fotoelettrico e dalla diffusione Compton. Cosi' pure gli elettroni, che normalmente sono considerati particelle, presentano proprieta' ondulatorie di interferenza e di diffrazione.
In generale, tutti i portatori di quantita' di moto e di energia come elettroni, atomi, luce, possono avere sia una natura corpuscolare sia una natura ondulatoria.
OSSERVAZIONE
Nella Fisica classica sembra che i concetti di onda e di particella si escludano a vicenda.
Una particella classica si comporta come una palla da biliardo, essa puo' essere localizzata, diffusa e, negli urti, obbedisce ai principi di conservazione dell'energia e della quantita' di moto. Una tale particella non presenta fenomeni di interferenza o diffrazione.
Un'onda classica, d'altro canto, si comporta come un'onda nell'acqua, essa mostra fenomeni di diffrazione ed interferenza e la sua energia si propaga continuamente nello spazio e nel tempo.
Niente puo' essere al tempo stesso una particella classica ed un'onda classica.
Spesso pero' il concetto di particella classica e quello di onda classica danno lo stesso risultato. Difatti, se la lunghezza d'onda e' molto piccola, non si riesce piu' a distinguere la propagazione di un'onda classica da quella di una particella classica. Per onde di lunghezza d'onda piccolissima gli effetti di diffrazione sono trascurabili e le onde viaggiano su traiettorie rettilinee. In modo analogo, non si osserva interferenza per onde di piccolissima lunghezza d'onda, perche' le frange di interferenza, essendo troppo vicine, non possono essere osservate.
In definitiva,
la luce puo' essere considerata come un'onda che si propaga lungo raggi, cosi' come avviene nell'ottica geometrica; oppure la si puo' considerare come un fascio di fotoni.
Analogamente
un elettrone puo' essere considerato come un'onda che si propaga in linea retta secondo raggi o, piu' semplicemente, come una particella.